jeram
sains
Selasa, 19 April 2011
sedih
dulu waktu saya kecil, mana pernah bapa gendong saya ngajak saya jalan-jalan dimotor meskipun cuma keliling-keliling kampung. mana pernah. tapi sekarang, sama anak kecil itu, bapak kayak ke anak sendiri. saya iri Pak. saya iri melihat bapak segitunya sama anak itu. saya memang puas secara lahir, bapak selalu belikan apapun yng saya minta, tapi yang batinnya mana? saya iri sama orang lain yang cerita kedekatan mereka sama bapaknya. lalu apa yang harus saya bagikan ke temen-temen soal kedekatan saya sama bapak? gak ada Pak, nonsens. saya sedih Pak. jujur saya menyesal dilahirkan kedunia ini kalau hanya untuk melihat dan merasakan kesakitan seperti ini.
Minggu, 19 Desember 2010
Senin, 06 Desember 2010
GITAR
Jenis Gitar
- The Pick Guitar
- The Finger-Style Guitar
Senin, 27 September 2010
my project
aku seorang lelaki tulen
dan ia seorang wanita nyata
apa yang jadi sebuah kesamaan ,yaitu manusia
aku selalu
tertawa dan aku tau wanita itupun pasti pernah
tertawa bahkan sering
tertawa. tapi dia selalu mengatakan bahwa aku dengannya tak pernah punya
kesamaan. padahal setauku, aku selalu
makan dan minum, begitupun dia, aku selalu
berbicara kepada orang lain begitupun dia. tapi dia tetap saja menganggap itu sebuah
perbedaan. dasar
wanita nyata.
aku selalu
menertawakan diriku sendiri dan
tertawa melihat kekonyolanku yang selalu
tertawa sendiri tanpa ada penyebab yang pasti mengapa aku selalu
tertawa sendiri. tapi itulah aku yang selalu
tertawa sendiri ketika melihat diriku sendiri
tertawa sendiri. sungguh
ironi. aku disebut
gila oleh wanita nyata itu. padahal dulu,
diapun pernah sepertiku,
tertawa-tawa sendiri di dalam kelas tanpa ada yang
lucu.
Kamis, 16 September 2010
Gravitasi
Hukum Gravitasi Universal Newton
Hukum gravitasi universal Newton dirumuskan sebagai berikut:- Setiap massa titik menarik semua massa titik lainnya dengan gaya segaris dengan garis yang menghubungkan kedua titik. Besar gaya tersebut berbanding lurus dengan perkalian kedua massa tersebut dan berbanding terbalik dengan kuadrat jarak antara kedua massa titik tersebut.
- F adalah besar dari gaya gravitasi antara kedua massa titik tersebut
- G adalah konstanta gravitasi
- m1 adalah besar massa titik pertama
- m2 adalah besar massa titik kedua
- r adalah jarak antara kedua massa titik, dan
- g adalah percepatan gravitasi =
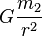
Dari persamaan ini dapat diturunkan persamaan untuk menghitung Berat. Berat suatu benda adalah hasil kali massa benda tersebut dengan percepatan gravitasi bumi. Persamaan tersebut dapat dituliskan sebagai berikut: W = mg. W adalah gaya berat benda tersebut, m adalah massa dan g adalah percepatan gravitasi. Percepatan gravitasi ini berbeda-beda dari satu tempat ke tempat lain.
Senin, 06 September 2010
konfigurasi elektron
Dalam fisika atom dan kimia kuantum, konfigurasi elektron adalah susunan elektron-elektron pada sebuah atom, molekul, atau struktur fisik lainnya.[1] Sama seperti partikel elementer lainnya, elektron patuh pada hukum mekanika kuantum dan menampilkan sifat-sifat bak-partikel maupun bak-gelombang. Secara formal, keadaan kuantum elektron tertentu ditentukan oleh fungsi gelombangnya, yaitu sebuah fungsi ruang dan waktu yang bernilai kompleks. Menurut interpretasi mekanika kuantum Copenhagen, posisi sebuah elektron tidak bisa ditentukan kecuali setelah adanya aksi pengukuran yang menyebabkannya untuk bisa dideteksi. Probabilitas aksi pengukuran akan mendeteksi sebuah elektron pada titik tertentu pada ruang adalah proporsional terhadap kuadrat nilai absolut fungsi gelombang pada titik tersebut.
Elektron-elektron dapat berpindah dari satu aras energi ke aras energi yang lainnya dengan emisi atau absorpsi kuantum energi dalam bentuk foton. Oleh karena asas larangan Pauli, tidak boleh ada lebih dari dua elektron yang dapat menempati sebuah orbital atom, sehingga elektron hanya akan meloncat dari satu orbital ke orbital yang lainnya hanya jika terdapat kekosongan di dalamnya.
Pengetahuan atas konfigurasi elektron atom-atom sangat berguna dalam membantu pemahaman struktur tabel periodik unsur-unsur. Konsep ini juga berguna dalam menjelaskan ikatan kimia yang menjaga atom-atom tetap bersama.
Kelopak dan subkelopak
Konfigurasi elektron yang pertama kali dipikirkan adalah berdasarkan pada model atom model Bohr. Adalah umum membicarakan kelopak maupun subkelopak walaupun sudah terdapat kemajuan dalam pemahaman sifat-sifat mekania kuantum elektron. Berdasarkan asas larangan Pauli, sebuah orbital hanya dapat menampung maksimal dua elektron. Namun pada kasus-kasus tertentu, terdapat beberapa orbital yang memiliki aras energi yang sama (dikatakan berdegenerasi), dan orbital-orbital ini dihitung bersama dalam konfigurasi elektron.
Kelopak elektron merupakan sekumpulan orbital-orbital atom yang memiliki bilangan kuantum utama n yang sama, sehingga orbital 3s, orbital-orbital 3p, dan orbital-orbital 3d semuanya merupakan bagian dari kelopak ketiga. Sebuah kelopak elektron dapat menampung 2n2 elektron; kelopak pertama dapat menampung 2 elektron, kelopak kedua 8 elektron, dan kelopak ketiga 18 elektron, demikian seterusnya.
Subkelopak elektron merupakan sekelompok orbital-orbital yang mempunyai label orbital yang sama, yakni yang memiliki nilai n dan l yang sama. Sehingga tiga orbital 2p membentuk satu subkelopak, yang dapat menampung enam elektron. Jumlah elektron yang dapat ditampung pada sebuah subkelopak berjumlah 2(2l+1); sehingga subkelopak "s" dapat menampung 2 elektron, subkelopak "p" 6 elektron, subkelopak "d" 10 elektron, dan subkelopak "f" 14 elektron.
Jumlah elektron yang dapat menduduki setiap kelopak dan subkelopak berasal dari persamaan mekanika kuantum,[2] terutama asas larangan Pauli yang menyatakan bahwa tidak ada dua elektron dalam satu atom yang bisa mempunyai nilai yang sama pada keempat bilangan kuantumnya
Notasi
Para fisikawan dan kimiawan menggunakan notasi standar untuk mendeskripsikan konfigurasi-konfigurasi elektron atom dan molekul. Untuk atom, notasinya terdiri dari untaian label orbital atom (misalnya 1s, 3d, 4f) dengan jumlah elektron dituliskan pada setiap orbital (atau sekelompok orbital yang mempunyai label yang sama). Sebagai contoh, hidrogen mempunyai satu elektron pada orbital s kelopak pertama, sehingga konfigurasinya ditulis sebagai 1s1. Litium mempunyai dua elektron pada subkelopak 1s dan satu elektron pada subkelopak 2s, sehingga konfigurasi elektronnya ditulis sebagai 1s2 2s1. Fosfor (bilangan atom 15) mempunyai konfigurasi elektron : 1s2 2s2 2p6 3s2 3p3.
Untuk atom dengan banyak elektron, notasi ini akan menjadi sangat panjang, sehingga notasi yang disingkat sering digunakan. Konfigurasi elektron fosfor, misalnya, berbeda dari neon (1s2 2s2 2p6) hanya pada keberadaan kelopak ketiga. Sehingga konfigurasi elektron neon dapat digunakan untuk menyingkat konfigurasi elektron fosfor. Konfigurasi elektron fosfor kemudian dapat ditulis: [Ne] 3s2 3p3. Konvensi ini sangat berguna karena elektron-elektron pada kelopak terluar sajalah yang paling menentukan sifat-sifat kimiawi sebuah unsur.
Urutan penulisan orbital tidaklah tetap, beberapa sumber mengelompokkan semua orbital dengan nilai n yang sama bersama, sedangkan sumber lainnya mengikuti urutan berdasarkan asas Aufbau. Sehingga konfigurasi Besi dapat ditulis sebagai [Ar] 3d6 4s2 ataupun [Ar] 4s2 3d6 (mengikuti asas Aufbau).
Adalah umum untuk menemukan label-label orbital "s", "p", "d", "f" ditulis miring, walaupaun IUPAC merekomendasikan penulisan normal. Pemilihan huruf "s", "p", "d", "f" berasal dari sistem lama dalam mengkategorikan garis spektra, yakni "sharp", "principal", "diffuse", dan "fine". Setelah "f", label selanjutnya diikuti secara alfabetis, yakni "g", "h", "i", ...dst, walaupun orbital-orbital ini belum ditemukan.
Konfigurasi elektron molekul ditulis dengan cara yang sama, kecuali bahwa label orbital molekullah yang digunakan, dan bukannya label orbital atom.
